Stereochemical
considering in Planning Synthesis
Stereochemical
consideration and eudismic ratio in chiral drug development
Selama lima belas
sampai dua puluh tahun terakhir, stereokimia mendapar perhatian terpenting
dalam praktek farmasi. Sebagai hasil dari kemajuan dalam teknologi kimia yang
terkait dengan sintesis, pemisahan, identifikasi dan analisis tunggal
enantiomer hadir dalam senyawa rasemat, beberapa obat kiral disajikan sebagai
enansiomer tunggal untuk persetujuan dari pihak berwenang. Sebaliknya untuk
memperkenalkan senyawa rasemat, enansiomer tunggal selalu memiliki selektivitas
yang lebih baik pada reseptor mengakibatkan tindakan terapi unggul dengan beban
metabolik sedikit dan efek samping yang lebih sedikit. Enzim-enzim atau asam
amino atau situs mengikat telah lama diakui menjadi stereoselektif yang
dipertimbangkan dalam pengembangan obat kiral. Setiap enansiomer berinteraksi
secara berbeda dengan reseptor, memunculkan respon berbeda dan potensi
enansiomer tergantung pada rasio eudismic atau indeks eudismic atau indeks
stereospesifik senyawa. Oleh karena itu rasio Eudismic juga merupakan alat
penting dalam merancang obat kiral.
Oleh karena
itu,enansiomer tunggal selalu memiliki keunggulan dibandingkan rasemat. Tubuh
kita dapat mengenali hanya satu enansiomer yang pada hasilnya menghasilkan efek
terapeutik; lain mungkin memiliki efek yang tidak diinginkan/tidak ada
efek/efek racun. Minat dalam stereokimia obat telah dihasilkan dari kemajuan
yang cukup besar dalam sintesis,analisis,pemisahan dan formulasi senyawa kiral,
bersama-sama dengan peningkatan apresiasi terhadap potensi signifikan sifat
biologis diferensial dari enansiomer dari obat kiral. Untuk beberapa
terapi,formulasi enansiomer tunggal dapat memberikan selektivitas yang lebih
besar untuk target biologisnya,meningkatkan indeks terapeutik dan
farmakokinetik yang lebih baik daripada campuran enansiomer. Dalam beberapa
kasus, baik campuran maupun formulasi tunggal enansiomer obat akan tersedia
secara bersamaan.
Kompleks yang
terbentuk antara reseptor dan dua enansiomer adalah diastereomer,bukan
enansiomer-enansiomer dan sebagai akibatnya mereka memiliki energi dan sifat
kimia yang berbeda. Kiral antihistamine dexchlorpheneramine sabfat stereo
selektif; S-(+)- isomer sekitar 200 kali lebih kuat daripada R-(+)- isomer.
Aktivitas enansiomer adalah hasil interaksi antara dirinya dengan situs aktif
sistem biologi. Oleh karena itu penting untuk memahami interaksi aktif obat
secara optik dengan enzim atau reseptor serta bagaimana obat tersebut mampu
menghasilkan efek terapeutik yang berbeda pada tingkat mekanistik. Dalam
contoh Gambar .1 gugus hidroksil R-(-)- epinefrin dapat lebih
sesuai dengan situs aktif dalam enzim dan menghasilkan efek terapeutik yang
diinginkan secara efeisien tetapi gugus hidroksil S-(+) epinefrin tidak dapat
mengakomodasi dirinya pada site activ atau bahkan menimbulkan kerugian dari
interaksi steriknya. Akibatnya S-(+) memiliki energi ikat yang lebih rendah dan
kurang aktif dibandingkan R-(-)-. Kiralitas merupakan sifat dasar istem
biologis dan mencerminkan materi asimetri yang mendasarinya.
Stereochemical
Strategies
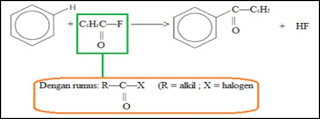
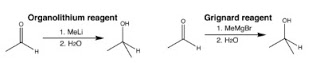
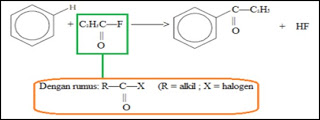
Sejumlah pereaksi
kimia memiliki kebutuhan stereokimia yang berbeda. Transformasi stereokimia
(seperti penataan ulang Claisen dan reaksi Misunobu) dapat menghilangkan atau
memindahkan kekhiralan yang diinginkan sehingga menyederhanakan
target. Strategi berbasis-stereokimia terdiri atas penghapusan
stereosentris dan stereorelasi yang terkendali. Stereokontrol seperti itu dapat
muncul dari kontrol struktur substrat atau dari kontrol mekanisme transformasi.
Dalam kasus yang
kemudian, retron dari transformasi tertentu mengandung informasi stereokimia
kritis (absolut atau relatif) pada satu atau lebih
stereocenters. Stereocomplexity tergantung pada jumlah elemen stereogenik
yang ada dalam sebuah molekul dan lokasi spasial dan topologi mereka relatif
satu sama lain. Unsur stereogenik adalah fokus stereoisomerisme (pusat
stereogenik, sumbu, atau bidang) dalam molekul seperti itu bahwa pertukaran dua
ligan (yaitu 1 dan 2) yang melekat pada atom dalam molekul seperti itu mengarah
ke stereisomer.
Dari sudut pandang
sintetis, pengenalan pusat-pusat stereogenik baru ke dalam TGT biasanya dicapai
dengan menggunakan dua proses yang berbeda secara mendasar :
Paling sering melalui
penambahan satu atau wajah stereoheterotopic (enantio- atau diastereotopic)
lainnya dari ikatan rangkap, tetapi juga dengan modifikasi selektif atau
penggantian ligan stereoheterotopic.
Dari sudut pandang
retrosintetik, penghapusan selektif unsur-unsur stereogenik tergantung pada
ketersediaan transformasi stereosimplifikasi, pembentukan retron yang
diperlukan dan kehadiran lingkungan spasial yang menguntungkan di prekursor
yang dihasilkan oleh aplikasi transformasi tersebut. Stereokontrol pada
transformasi stereosimplifikasi dapat diandalkan :
1. Mekanisme
2. Substrat atau reagen
struktur bias (efek sterik / stereoelectronic harus dipertimbangkan)
1. Bagaimana pengetahuan perancangan sintesis senyawa organik dapat berfungsi sebagai penunjang keberhasilan dalam sintesis?
2. Bagaimana jika produk dari suatu reaksi tidak stereoselektif?